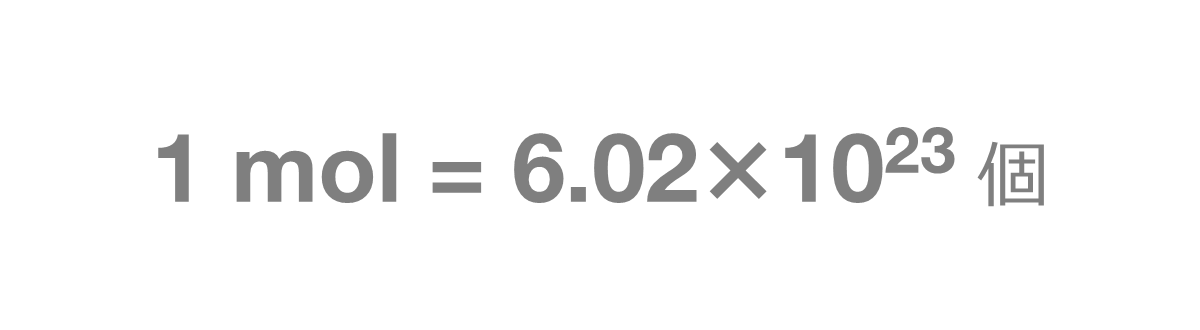ボイル・シャルルの法則とアボガドロの法則

ここでは、気体の体積が圧力、温度、物質量によってどの様に変化するか、その法則性について学んでいきます。
まずは、気体の体積と圧力の関係を示したボイルの法則、絶対温度との関係を示したシャルルの法則、それらをまとめたボイル・シャルルの法則について確認していきましょう。
さらに、気体の体積と物質量の関係を示したアボガドロの法則についても見ていきます。
スポンサーリンク
ボイルの法則
ボイルの法則とは、温度が一定のとき、気体の体積は圧力の大きさに反比例するという法則のことです。
すなわち、気体に圧力をかけるほど、体積は小さくなります。
圧力を\(P\)[atm]、気体の体積を\(V\)[L]、定数を\(k\) とすると、気体の体積が圧力に反比例することを次の式で表せます。
$$V = \frac{k}{P}$$
式変形し、下の様に表されることもあります。
$$PV = k$$
ボイルの法則を実感できる身近な例をいくつか示しましょう。
山の上で飲んでいたペットボトルが、山を降りると大気圧が増加し潰れてしまう。これは、圧力が大きくなる例です。
また、山にのぼると大気圧が減少し、ポテトチップスの袋が膨らむ。これは、圧力が小さくなる例です。
シャルルの法則
シャルルの法則とは、圧力が一定のとき、気体の体積は絶対温度に比例するという法則のことです。
セ氏温度を基準にして表現すると1℃上昇するごとに0℃(273K)の体積の273分の1ずつ上昇するといえます。気体の熱膨張について表した法則でもあります。
温度が上昇するほど気体の体積が大きくなります。
気体の体積を\(V\)[L]、絶対温度を\(T\)[K]、定数を\(k\) とすると、気体の体積が絶対温度に比例することを次の式で表せます。
$$V = kT$$
圧力が一定のとき、気体の体積と絶対温度の比が一定なので、式変形し下の様に表すこともできます。
$$\frac{V}{T} = k$$
シャルルの法則の身近な例についても示しておきましょう。
ヤカンを加熱すると、お湯から発生した蒸気の体積が増加し、フタが浮き上がる。これは温度上昇による例です。
スポンサーリンク
セルシウス温度と絶対温度
ここで温度の2つの定義について整理しておきます。
セルシウス温度
まず、セルシウス温度(セ氏温度)とは、水を基準にしてつくられた温度です。
水の凝固点(氷点)を0度、沸点を100度とし、その間を100等分して1度として定義した温度のことです。単位は℃を用います。
普段、皆さんが一般的に使用しているものですね。
絶対温度
それに対して、絶対温度とは、熱振動を基準にした温度です。
物質の熱振動が停止する温度を0度(絶対零度)と定義した温度のことです。単位はK(ケルビン)を用います。
0 Kは-273℃になります。すなわち、絶対温度\(T\)[K] とセ氏温度\(t\)[℃]は、\(T=t+273\) の関係になっています。
ボイル・シャルルの法則
ボイル・シャルルの法則とはボイルの法則とシャルルの法則をまとめた法則のことです。すなわち、気体の体積は、圧力に反比例し、絶対温度に比例するという法則です。
圧力を\(P\)[atm]、気体の体積を\(V\)[L]、絶対温度を\(T\)[K]、定数を\(k\) とすると、気体の体積\(V\)が圧力\(P\)に反比例し絶対温度\(T\)に比例することを次の式で表せます。
$$V = k\frac{T}{P}$$
式変形し、下の様に表すこともできます。
$$\frac{PV}{T} = k$$
アボガドロの法則
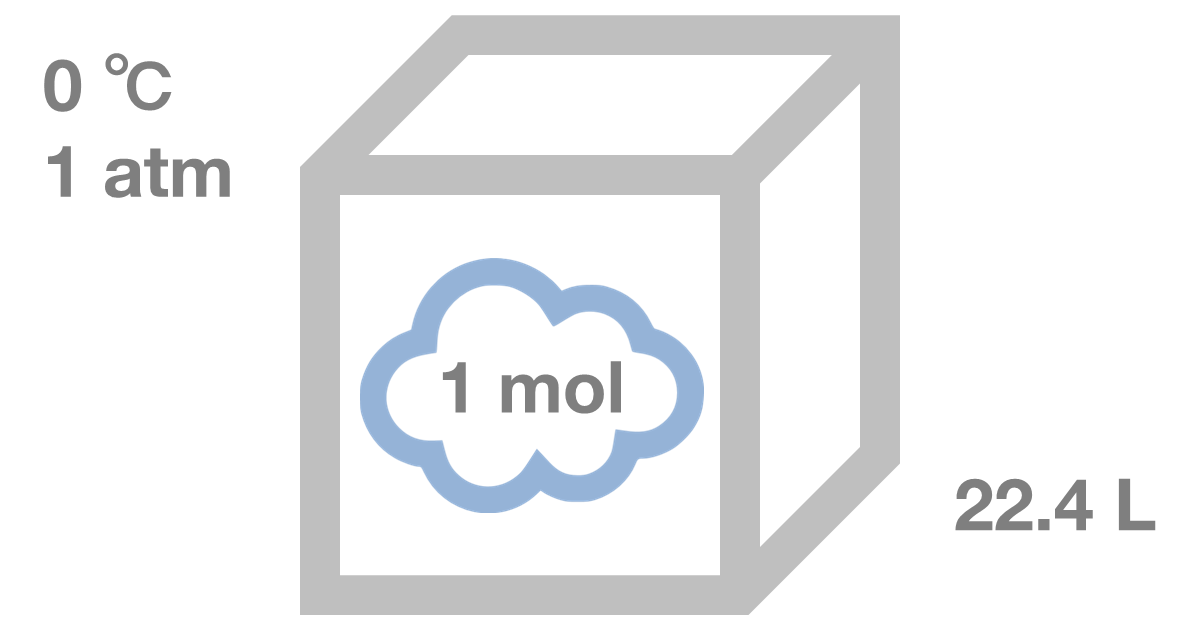
アボガドロの法則とは、全ての気体は、同一温度、同一圧力の下で、同一体積に同じ数の分子が含まれるという法則のことです。
具体的には、標準状態(0℃、1atm)で22.4L中に1molの気体分子が含まれます。
なお、1mol(モル)とは、6.02×1023個の集団を表します。
詳細については、「モルって何?」のページをご覧ください。
スポンサーリンク