熱とは何か - 熱量、比熱、熱容量 3つの概念

熱の基本的な概念である熱量、比熱、熱容量について学びます。
まず、熱とは何かについて説明しましょう。
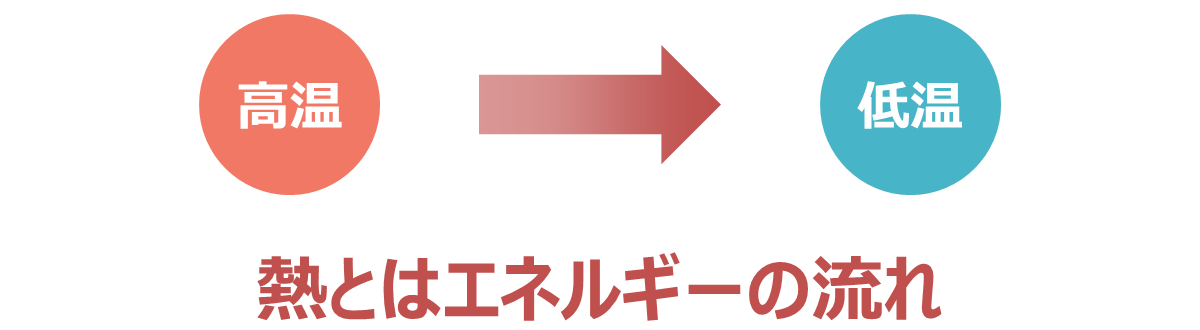
熱とは、物質間のエネルギーの流れのことを意味します。必ず高温の物質から低温の物質に移動するという性質があります。
スポンサーリンク
熱量
熱量とは、物体間でのエネルギーの流れ、すなわち熱の量を数値化したものです。記号は\(Q\)(heat QuantityのQ)、単位はJ(ジュール)を用います。
ジュールとは
ここで熱量に使われているJ(ジュール)という単位について、定義を確認しておきましょう。
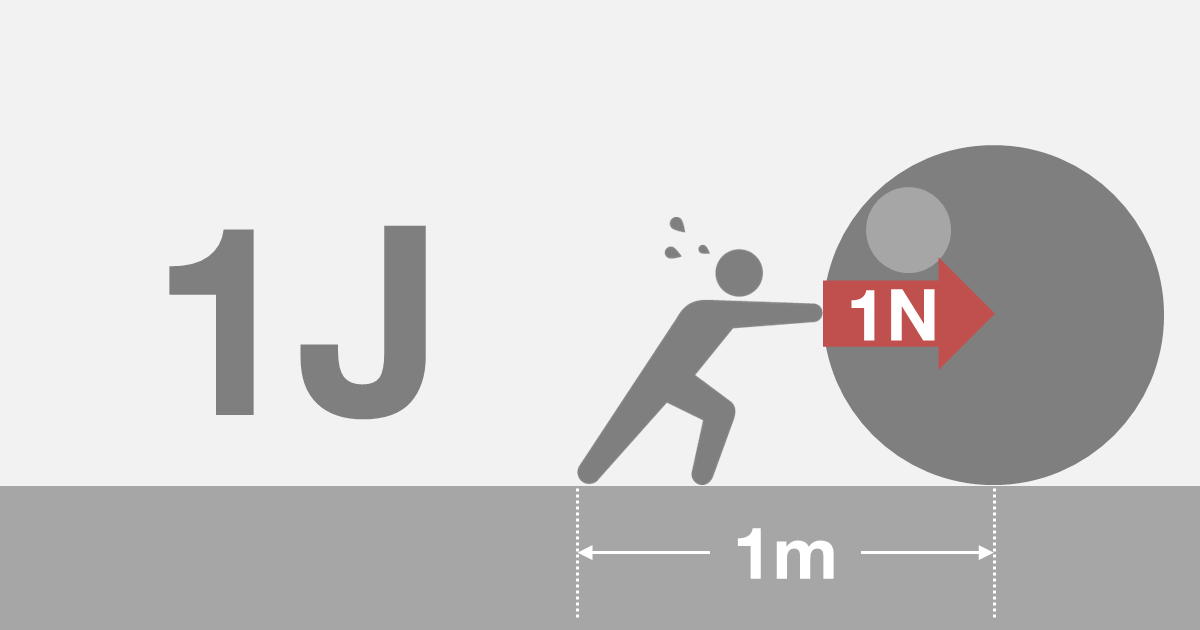
J(ジュール)とは、物体に力を加え移動させる仕事に必要なエネルギーの量を表す単位です。
1Jは、物体を1Nの力で1m移動させる仕事に必要なエネルギーの量と定義されています。よって、1J = 1N·m(ニュートンメートル)となります。
熱量は、物質間を移動するエネルギーの量を表してますので、エネルギーの単位であるJを使用します。
余談ですが、1Jは、地球上で約102gの物体(リンゴ程の重さ)を1m持ち上げる仕事に必要なエネルギーと同じになります。リンゴで例えているのは、アイザック・ニュートンが木からリンゴが落ちるのを見て万有引力を発見したというエピソードにちなんでいるためです。
ジュールとカロリー
以前は、水1gを1℃上昇させるのに必要な熱量として1cal(カロリー)が使用されていました。1calは、4.186Jです。4.186という数値は、後述する水の比熱と同じ数値になります。
スポンサーリンク
比熱(比熱容量)
比熱(ひねつ)とは、物質1g の温度を1℃(K)上昇させるのに必要な熱量のことです。比熱容量(ひねつようりょう)ともいいます。
記号は\(c\)(小文字のc)、単位はJ/(g·℃)またはJ/(g·K)(ジュール毎グラム毎ケルビン)を用います。
比熱\(c\)[J/g·K]は、質量\(m\)[g]の物体に熱量\(Q\)[J]を与えた時に生じる温度差\(\varDelta T\)[K]を使って式で表すと、次のようになります。
$$c = \frac{Q}{m \times \varDelta T}$$
この式を変形させることで、質量\(m\)[g]、比熱\(c\)[J/(g·K)]の物質を\(\varDelta T\)[K]上昇させるのに必要な熱量\(Q\)[J]がわかります。
$$Q = m \times c \times \varDelta T$$
比熱の大小でわかること
比熱は、物質1gの温度変化のしにくさ(温まりにくさ冷めにくさ)を表しているともいえます。
比熱の大きな物質ほど温度差を生じさせるのに大きな熱量が必要になるため、温まりにくく冷めにくいです。逆に、比熱の小さな物質は小さな熱量で温度差を生じることができるため、温まりやすく冷めやすいです。
水の比熱
水は、液体の中で最も比熱が大きいことが知られており、その値は4.186 J/(g·℃)(またはJ/(g·K))となります。つまり、水1gを1℃上昇させるのに4.186J必要ということです。昔は、これを1calと言っていました。
水の比熱の大きさというのは、日常生活でも実感することができます。例えば、夏の海岸では同じ量の太陽の光が降り注いでいるのにも関わらず、砂浜は歩くのが困難な程、熱くなります。それに比べて、海水の温度上昇はわずかです。
これは、水の比熱が砂の比熱よりも大きい(水の方が砂より温まりにくい)ことが原因で起こる現象です。
水の温まりにくい性質は、消火剤として非常に優れています。
その他の用途としては、水まくら、熱交換器の熱媒体、原子炉の冷却などが挙げられます。
また、冷めにくい性質は湯たんぽなどとして活用されています。
リチウムの比熱
リチウムは、固体金属の中で最も比熱が大きい元素として知られています。これも覚えておきましょう。
気体の比熱は、2種類ある
気体は、加熱による体膨張が大きいため、体積を一定にして加熱する場合と圧力を一定にしながら加熱する場合の2種類考える必要があります。(参考:気体のモル比熱)
熱容量
熱容量とは、任意の量の物質の温度を1℃上昇させるのに必要な熱量のことです。記号は\(C\)(heat CapacityのC、大文字)、単位はJ/℃またはJ/K(ジュール毎ケルビン)を用います。
熱容量\(C\)[J/K]は、物質の質量\(m\)[g]と比熱\(c\)[J/g·K]を用いて次のように表すことができます。
$$C = m \times c$$
比熱と熱容量の違い
比熱と熱容量の違いは、対象としている物質の量の違いになります。比熱が物質1gを対象としているのに対して、熱容量では任意の量(ある量)を対象としています。
記号はまぎらわしいですが、比熱は\(c\)(スモールシー)、熱容量は\(C\)(ラージシー)で表されます。
スポンサーリンク