ドルトンの法則、グレアムの法則
気体の法則 第3弾です。
ここでは、混合気体の圧力に関する法則(ドルトンの法則)と気体の拡散速度に関する法則(グレアムの法則)について学びます。
スポンサーリンク
ドルトンの法則(ドルトンの分圧の法則)
ここでは、混合気体に関する法則を学びます。
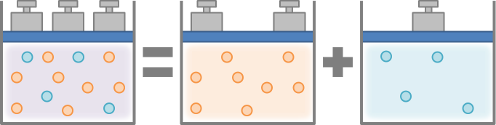
混合気体(こんごうきたい)とは、2種類以上の異なる気体の混合物のことです。例えば、空気は窒素と酸素の混合気体です。
混合気体の圧力には、ドルトンの法則が成り立ちます。
ドルトンの法則(ドルトンの分圧の法則)とは、混合気体の圧力は、それを構成する成分気体の圧力の和に等しいという法則のことです。
全圧と分圧
なお、混合気体の圧力のことを全圧(ぜんあつ)、成分気体(が単独で混合気体と同体積を占めたとした時)の圧力のことを分圧(ぶんあつ)といいます。
全圧、分圧といった言葉を使って表すと、ドルトンの法則は、「全圧は分圧の和に等しい」と表現することができます。
関係式
ここで、互いに反応しない\(n\)種類の気体からなる混合気体を考えてみます。
全圧を\(P\)、各気体成分の分圧を\(P_A\)、\(P_B\)、\(P_C\)、…\(P_n\)とすると
$$P = P_A + P_B + P_C + ・・・ + P_n$$
と表すことができます。
\(P\)が\(P_A\)と\(P_B\)のみで成り立っているときは、下の図のようになります。
登山と酸欠
余談ですが、空気中の酸素の分圧は、呼吸にも大いに関係しています。
息を吸う事で取り込まれた酸素は血液中に溶け込みますが、体内をくまなく行き渡るためには酸素の分圧が0.2気圧(1気圧×0.2)必要とされています。
山に登るなどして、圧力が下がると血中酸素濃度が低下して酸欠状態になってしまいます。
グレアムの法則
グレアムの法則とは、気体の拡散速度は、気体の分子量の平方根に反比例するという法則です。
たとえば、水素と二酸化炭素の拡散速度を比較してみましょう。
水素(H2)の分子量は2なので、拡散速度は、\(\frac{1}{\sqrt{2}}\)になります。
また、二酸化炭素(CO2)の分子量は44なので、拡散速度は、\(\frac{1}{\sqrt{44}}\)になります。
よって、$$\frac{1}{\sqrt{2}} ÷ \frac{1}{\sqrt{44}} ≒ 4.7$$になるので、計算結果から、水素の方が二酸化炭素より約4.7倍も拡散速度が速いことがわかります。
スポンサーリンク