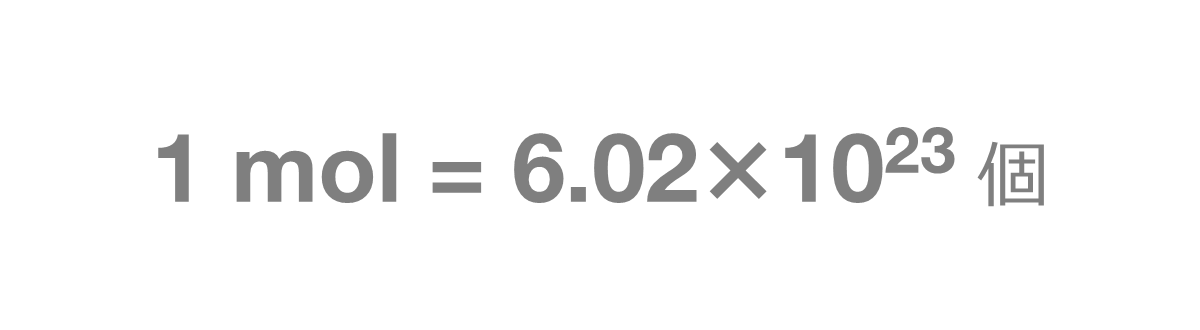気体のモル比熱

以前、固体や液体の比熱を中心に学習してきました。今回は、気体の比熱についてクローズアップして見ていきます。
気体の場合、固体や液体とは異なり、加熱による体膨張は非常に大きくなります。よって、温度上昇に使用される熱量の他、体膨張に使用される熱量も考える必要があります。
したがって、定積変化(体積を一定にして加熱)した場合と定圧変化(圧力を一定にしながら加熱)した場合の2種類の比熱が定義されています。
スポンサーリンク
モル比熱
気体では、普通の比熱ではなくモル比熱が用いられます。
モル比熱とは、物質1molの温度を1℃(K)上昇させるのに必要な熱量のことです。
また、mol(モル)とは、6.02×1023個の集団のことを表す単位です。
定積モル比熱(定積モル熱容量)
定積モル比熱(ていせきモルひねつ)とは、体積を一定に保ちながら、1molの気体を1K上昇させるのに必要な熱量のことをいいます。
例えば、密閉容器内の気体を加熱する場合を想定するといいでしょう。
記号は\(c_v\)で表され、単位はJ/(mol·K)となります。
定積モル比熱\(c_v\)[J/(mol·K)]は、定積変化において、物質量\(n\)[mol]の物体に熱量\(Q\)[J]を与えた時に生じる温度差\(\varDelta T\)[K]を使って式で表すと、次の様になります。
$$c_v = \frac{Q}{n \times \varDelta T}$$
この式を変形させることで、定積変化において、物質量\(n\)[mol]、定積モル比熱\(c_v\)[J/(mol·K)]の物質を\(\varDelta T\)[K]上昇させるのに必要な熱量\(Q\)[J]がわかります。
$$Q = n \times c_v \times \varDelta T$$
スポンサーリンク
定圧モル比熱(定圧モル熱容量)
定圧モル比熱(ていあつモルひねつ)とは、圧力を一定に保ちながら、1molの気体を1K上昇させるのに必要な熱量のことをいいます。
例えば、風船の中に入った少量の気体が加温により、風船を膨らませながら温度上昇していく場合を想定するといいでしょう。
下の写真は、気球内の空気を温めてふくらませている例です。
記号は\(c_p\)で表され、単位はJ/(mol·K)となります
定圧モル比熱\(c_p\)[J/(mol·K)]は、定圧変化において、物質量\(n\)[mol]の物体に熱量\(Q\)[J]を与えた時に生じる温度差\(\varDelta T\)[K]を使って式で表すと、次の様になります。
$$c_p = \frac{Q}{n \times \varDelta T}$$
この式を変形させることで、定圧変化において、物質量\(n\)[mol]、定圧モル比熱\(c_p\)[J/(mol·K)]の物質を\(\varDelta T\)[K]上昇させるのに必要な熱量\(Q\)[J]がわかります。
$$Q = n \times c_p \times \varDelta T$$
定積モル比熱と定圧モル比熱の関係
定圧変化では熱量の一部が体積の増加に使用されます。そのため、体積の変わらない定積変化よりも温度が上がりにくくなります。
その結果、定圧モル比熱は、定積モル比熱よりも大きな値をとります。
定圧モル比熱 > 定積モル比熱
一例を示すと、空気の定圧モル比熱は29.1J/(mol・K)、定積モル比熱は20.8J/(mol・K)になります。
この関係性について、さらに深掘りして考えてみましょう。
マイヤーの関係式
マイヤーの関係式とは、定圧比熱と定積比熱との間に成り立つ関係式のことです。
具体的にいうと、「定圧モル比熱と定積モル比熱の差は、気体定数に等しい」という関係になっています。
次の様に表すことができます。
$$c_p - c_v = R$$
上の例で出した空気の定圧モル比熱と定積モル比熱ついて確認してみると、29.1 - 20.8 = 8.3J/(mol・K)になり、気体定数の値になっていることがわかります。
スポンサーリンク