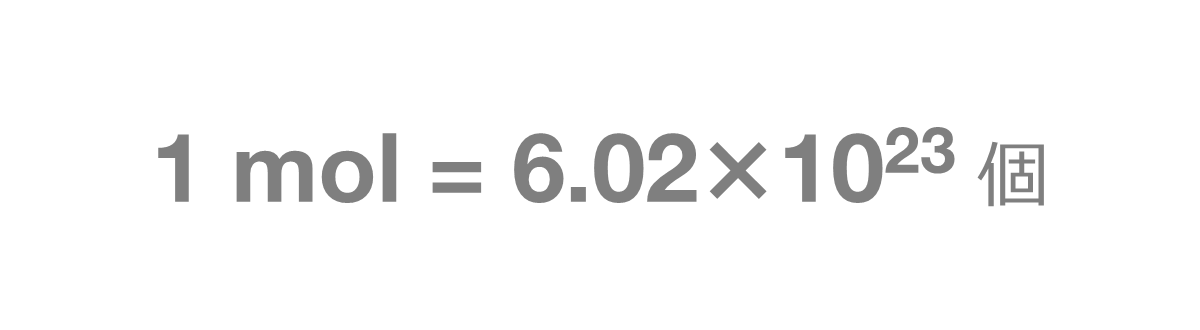モルって何? - 化学における数の数え方

化学における数の数え方、mol(モル)の単位について学びます。化学の計算で最も重要な概念になります。
スポンサーリンク
1モルとは
1mol(モル)とは、6.02×1023個の集団のことを表します。
物質量
mol(モル)を単位として表した物質の量のことを物質量(ぶっしつりょう)といいます。記号は\(n\)を用います。
昔は物質量のことをモル数といっていました。
物質量の概念を鉛筆の数え方で例えてみましょう。鉛筆は12本の集まりで1ダースと表現しますが、化学の世界では6.02×1023個の集まりを1molと表現します。
余談ですが、コップ1杯(約180g)の水には、約10molの水分子(H2O)が含まれています。
アボガドロ数とアボガドロ定数
物質1molに含まれる粒子の数である6.02×1023という数字は、アボガドロ数(アボガドロすう)と呼ばれています。
または1molあたりの粒子数である6.02×1023/molをアボガドロ定数(アボガドロていすう)といいます。記号は\(N_A\)、単位は/mol(または個/mol、mol-1)になります。
スポンサーリンク
なぜ6.02×1023個を1molとしたのか?
ここで、「なぜ6.02×1023個の様な切りの悪い数を1molとしたのか?」という疑問が湧くかもしれません。
原子量の基準を利用
その理由としては、原子量の定義が関係しています。原子量は、「質量数12の炭素原子(12C)」を12と定義しています。
そこで、基準に用いられている「質量数12の炭素(12C)」が12gあるとき、そこに含まれる炭素原子の個数を数えると6.02×1023個となります。この個数を、1molと定義し「物質量」の定義としています。
モル質量
モル質量(モルしつりょう)とは、1molあたりの質量のことです。記号は\(M\)、単位はg/mol(グラム毎モル)を用います。
その物質の原子量や分子量、式量にg(グラム)を付けたものと同じになります。
物質量\(n\)[mol]は、質量\(w\)[g]、モル質量\(M\)[g/mol]を使って次の様に表せます。
$$n = \frac{w}{M}$$
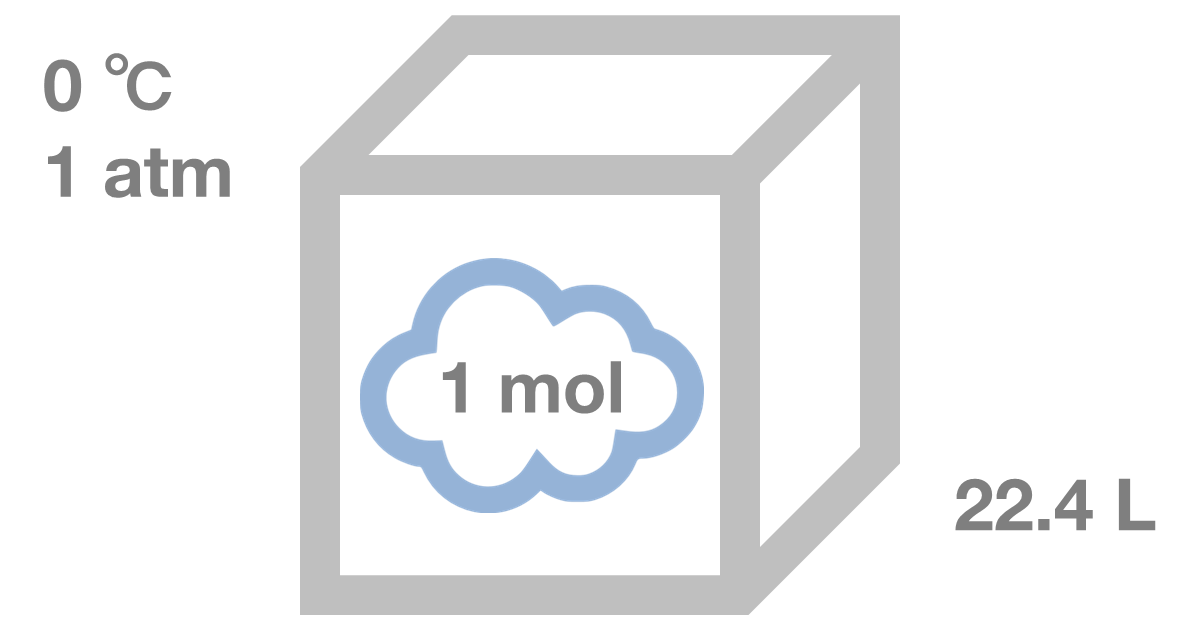
気体1molは、22.4L
アボガドロの法則より、どんな気体でも1molの体積は、標準状態(0℃、1気圧)のとき22.4Lになります。
すなわち、気体が2molなら44.8L(22.4L×2)、3molなら67.2L(22.4L×3)、…となります。
このことから、気体の体積は、物質量に比例することがわかります。
スポンサーリンク