反応速度 - 化学反応の速さをつかさどるもの

化学反応には、爆発のような速い反応から金属のサビのように遅い反応まで様々な速度の反応があります。
どうしてこの様な違いが生じるのでしょうか。それは、化学反応の速度を支配する要素の違いによるものです。その違いを確認する前に、まずは反応速度の定義から見ていきましょう。
スポンサーリンク
反応速度
反応速度(はんのうそくど)とは、化学反応の進む速さのことです。単位時間当たりの反応物の濃度変化で表します。反応速度は、活性化エネルギーの高低に依存します。
活性化エネルギー
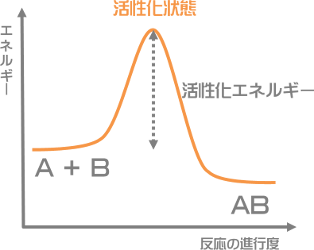
活性化エネルギー(かっせいかエネルギー)とは、化学反応を起こすのに必要最低限のエネルギーのことをいいます。
『A + B → AB』という反応を例に見ていきましょう。
反応物AとBから生成物ABをつくるためには、活性化状態というエネルギーの高い状態を経る必要があります。
活性化エネルギーは、その活性化状態になるのに必要なエネルギーなのです。
イメージ的には、ドミノ倒しの最初のひと押しといったところでしょうか。反応を起こすためには、最初に大きな力(活性化エネルギー)が必要ということです。
スポンサーリンク
反応速度を左右する条件
化学反応は、たとえ同じ反応であっても条件の違いによって速度が速くなったり遅くなったりします。
具体的には、温度の高低、圧力の大きさ、反応物の濃度、触媒の有無に依存します。
温度
温度が上昇するほど、反応速度は速くなります。温度の上昇に伴って、分子の運動が激しくなり分子同士の衝突回数が増え反応が促進されるためです。
圧力
圧力が大きくなるほど、反応速度は速くなります。圧力の上昇に伴って、分子の運動が激しくなり分子同士の衝突回数が増え反応が促進されるためです。
濃度
濃度が高くなるほど、反応速度は速くなります。濃度が高いほど、分子同士の衝突回数が増え反応が促進されるためです。
触媒
触媒(しょくばい)とは、反応速度を著しく増大させるが、反応前後でそれ自身は変化しない物質のことをいいます。触媒を加えることで活性化エネルギーが小さくなり、反応速度が速くなります。
また、触媒によって引き起こされる反応のことを触媒反応といいます。
負触媒
通常の触媒は、反応速度を速くするため正触媒(せいしょくばい)といわれることがあります。単に触媒というときは正触媒を意味します。
これとは逆に、反応速度を遅くさせる触媒を負触媒(ふしょくばい)といいます。
ちなみに、ハロゲン化物消火剤は、ハロゲン元素の負触媒効果を利用し、燃焼の連鎖反応を抑制することで消火しています。
スポンサーリンク