酸化と還元 - 酸素、水素、そして電子のやり取り

酸化と還元は、日常生活でもよく見られる化学反応の1つです。
例えば、金属のサビ(腐食)や燃焼は酸化反応です。また鉄は、鉄鉱石(酸化鉄)とコークスの反応で生成されますが、これは還元反応です。
この酸化と還元は、酸素、水素、電子のやり取りに着目した3つの定義があります。詳しく見ていきましょう。
スポンサーリンク
酸素のやり取りによる定義
物質が酸素と化合する反応を酸化(さんか)、酸素を失う反応を還元(かんげん)といいます。
例えば、10円玉は、銅(Cu)でできていますが、空気中の酸素で徐々に酸化され、酸化銅(Ⅱ)(CuO)になるため褐色に変色していきます。
これを化学反応式で表すと次の様になります。
2Cu + O2 → 2CuO
このとき、銅(Cu)は酸化され、酸素分子(O2)は還元されています。
また、酸化銅(Ⅱ)(CuO)と水素(H2)の反応では、水素は酸化され、銅が還元されます。
CuO + H2 → Cu + H2O
水素のやり取りによる定義
物質が水素を失う反応を酸化、水素と化合する反応を還元といいます。
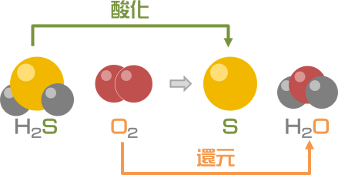
硫化水素(H2S)と酸素(O2)の反応では、硫黄は酸化され、酸素は還元されます。
2H2S + O2 → 2S + 2H2O
スポンサーリンク
電子のやり取りによる定義
物質が電子を失う反応を酸化、電子を受け取る反応を還元といいます。
以上の3つの定義で見てきた酸化反応、還元反応をまとめて酸化還元反応として以下にまとめます。
酸化還元反応
酸化還元反応(さんかかんげんはんのう)とは、2種類の物質間で酸素、水素、電子の授受が同時に起こる化学反応のことをいいます。
なお、英語で酸化はOxidation、還元はReductionということから酸化還元反応は、レドックス反応(Redox reaction)ともいいます。
酸化剤と還元剤
化学反応において、"相手を"酸化する物質を酸化剤、"相手を"還元する物質を還元剤といいます。
酸化と還元は同時に起こるので、一方の物質が酸化されたとしたら、もう一方の物質は還元されます。
危険物において、酸化剤としては第1類危険物(酸化性固体)と第6類危険物(酸化性液体)が該当します。
また、還元剤としては第2類危険物(可燃性固体)と第4類危険物(引火性液体)が該当します。
酸化剤として働く物質と還元剤として働く物質が混合すると、発火や爆発の危険性がある組み合わせもありますので注意しましょう。(参考:混合危険)
スポンサーリンク