イオン化傾向と電池

前ページで酸化と還元について学びました。
本ページでは、金属の陽イオンへのなりやすさと、その性質の差を利用した電池について学びます。
スポンサーリンク
金属のイオン化傾向
金属のイオン化傾向(イオンかけいこう)とは、水溶液中の金属の陽イオンへのなりやすさの相対尺度ことをいいます。
「陽イオンへのなりやすさ」といってもピンと来ないかもしれません。
日常的な言葉で言いかえれば、「水溶液中での溶けやすさ」、「酸化のしやすさ」、「腐食のしやすさ」、「サビやすさ」ということになります。
例えば、イオン化傾向の小さい金は、サビない金属として知られています。
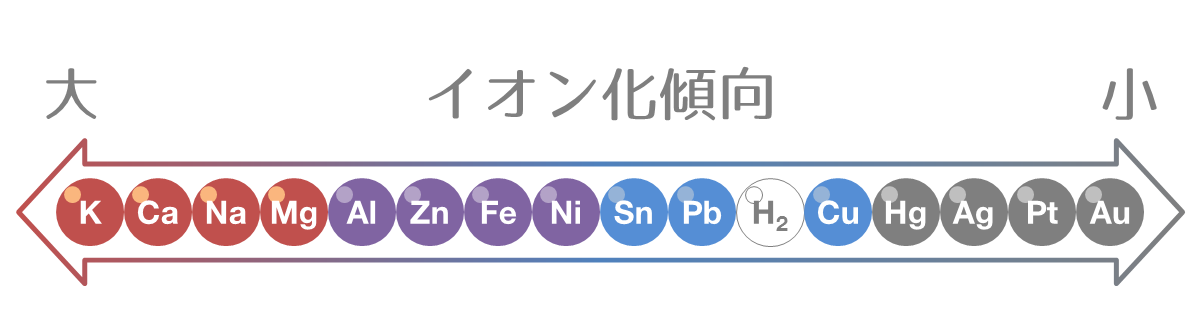
イオン化列
金属をイオン化傾向の大きい順に並べたものをイオン化列(イオンかれつ)といいます。
上の図では、金属でない水素(H2)を加えていますが、これは水素に陽イオンになろうとする性質があり、比較のために載せています。
ここで、危険物取扱者試験において重要な物質を確認しておきましょう。
以下は、第3類危険物や第2類危険物に指定されているものになります。
第3類危険物
第2類危険物
覚え方
金属のイオン化傾向は、「貸そうかな、まあ当てにするな、ひどすぎる借金」の語呂合わせで覚えると良いでしょう。
「貸そう(Kカリウム)か(Caカルシウム)な(Naナトリウム)、ま(Mgマグネシウム)あ(Alアルミニウム)当(Zn亜鉛)て(Fe鉄)に(Niニッケル)する(Snスズ)な(Pb鉛)、ひ(H水素)ど(Cu銅)す(Hg水銀)ぎ(Ag銀)る借(Pt白金)金(Au金)」
スポンサーリンク
卑金属と貴金属
イオン化傾向の大きな金属を卑金属(ひきんぞく)または卑な金属(ひなきんぞく)といいます。
また、イオン化傾向の小さな金属を貴金属(ききんぞく)または貴な金属(きなきんぞく)といいます。
化学的には、水素よりイオン化傾向が大きい金属を卑金属、小さい金属を貴金属に分類します。
電池
電池とは、2種類の金属のイオン化傾向の差を利用し起電力を発生させ、電流を生じさせる装置のことです。
ボルタ電池を例に見ていきましょう。
ボルタ電池は、希硫酸中に亜鉛(Zn)板と銅(Cu)板を浸し、導線でつないだ電池のことです。
ZnはCuよりもイオン化傾向が大きいので、酸化され亜鉛イオン(Zn2+)となって溶けていきます。
そのとき放出された電子(e-)はZn板からCu板へ移動します。
Zn → Zn2+ + 2e-(酸化反応)
Cu板まで移動したe-は電解液中の水素イオン(H+)と結びついて、水素(H2)を発生させます。
2H+ + 2e- → H2↑(還元反応)
スポンサーリンク