電解質と非電解質 - 水に溶けてイオンになる物質、ならない物質

今回は、溶解の発展形の内容です。
溶質が、水に溶けてイオンになる現象(電離)やイオンになる物質(電解質)、ならない物質(非電解質)について確認していきます。
スポンサーリンク
電離
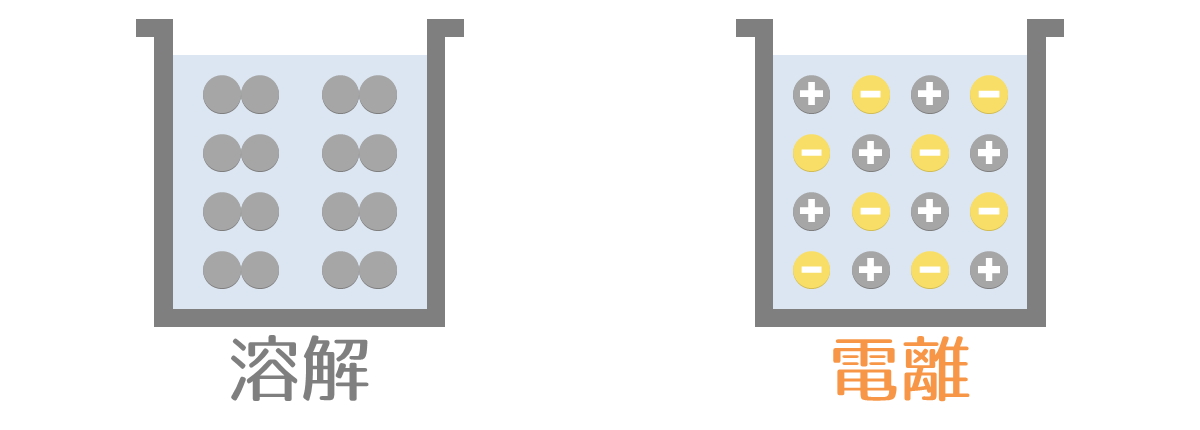
電離(でんり)とは、水溶液中で溶質が陽イオンと陰イオンに分かれる現象をいいます。
似た概念として溶解があります。
溶解と電離の違いは、溶解が単に溶けることを意味するのに対して、電離は溶解後にイオンに分離することを意味するところにあります。
電離する物質を電解質、電離しない物質を非電解質といいます。その違いを詳しく見ていきましょう。
電解質と非電解質の違い
電解質
電解質(でんかいしつ)とは、溶解して電離する物質のことをいいます。
電解質が溶けた溶液を電解溶液(でんかいようえき)または電解液(でんかいえき)といいます。電解溶液は、電気(電流)を流すという特徴があります。
電解質として当てはまるのはイオン性物質です。
例としては、塩化ナトリウム(NaCl)や塩化水素(HCl)などがあります。塩化水素(HCl)は、水に溶かすと陽イオンである水素イオン(H+)と陰イオンである塩化物イオン(Cl-)に電離します。
電解質の例
水に溶けて酸性や塩基性を示す酸や塩基が該当します。
- 塩化ナトリウム
- 塩化水素
- 塩化銅
- 硫酸
- 水酸化ナトリウム
スポンサーリンク
非電解質
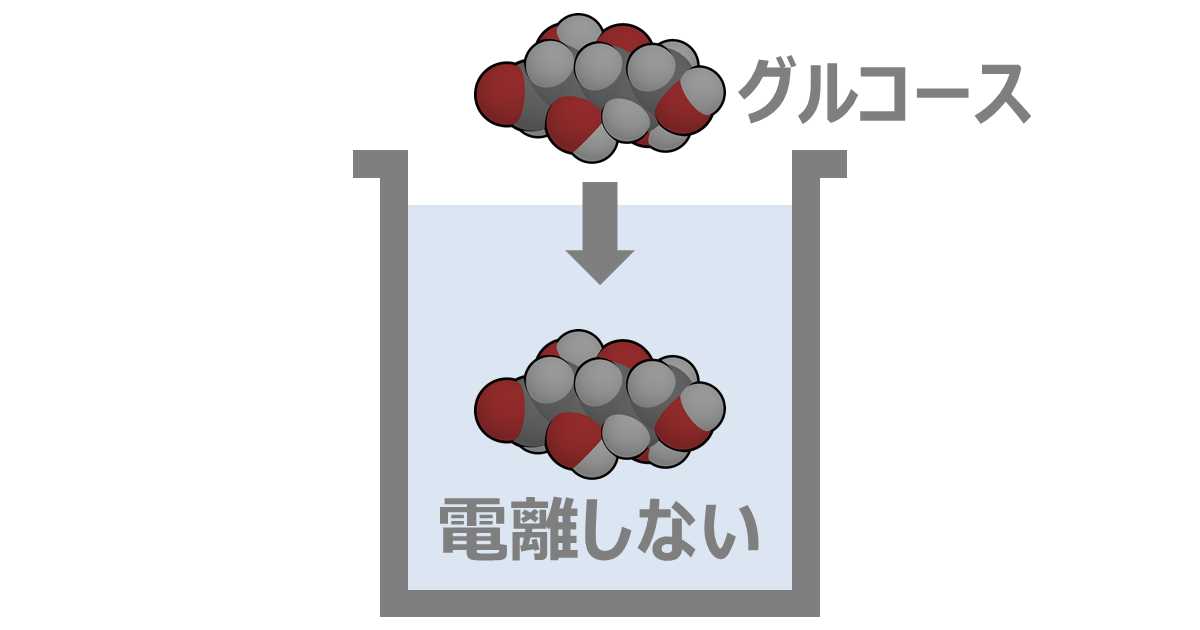
非電解質(ひでんかいしつ)とは、溶解しても電離しない物質のことをいいます。
電解溶液とは異なり、非電解質が溶けた溶液は、電気(電流)を流すことはありません。
非電解質として当てはまるのは分子性物質です。
例としては、ブドウ糖(グルコース)やショ糖(スクロース)、アルコール類などがあります。
非電解質の例
水に溶けても中性を示す"多くの"有機化合物が該当します。(有機化合物の中には電解質である物質も存在しています。)
- ブドウ糖(グルコース)
- ショ糖(スクロース)
- エタノール
以上より、電解質と非電解質の見分け方を一言で表すと、電気を通すか通さないかになります。
次に電離度について確認してみましょう。
電離度
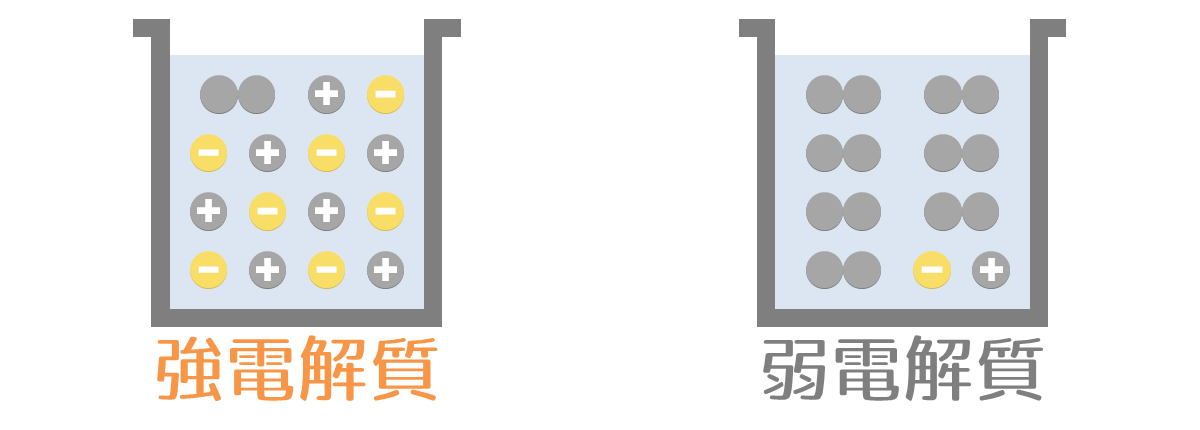
電離度(でんりど)とは、溶質が水溶液中で電離している割合のことをいいます。記号は、α(アルファ)を用います。
電離度は、比ですので単位は無く、0~1までの値をとります。
電離度が大きい(1に近い)物質を強電解質(きょうでんかいしつ)、電離度が小さい物質を弱電解質(じゃくでんかいしつ)といいます。
電離度の大小は、酸と塩基の強弱に利用されています。
スポンサーリンク