酸と塩基の分類 - 価数と電離度による見分け方
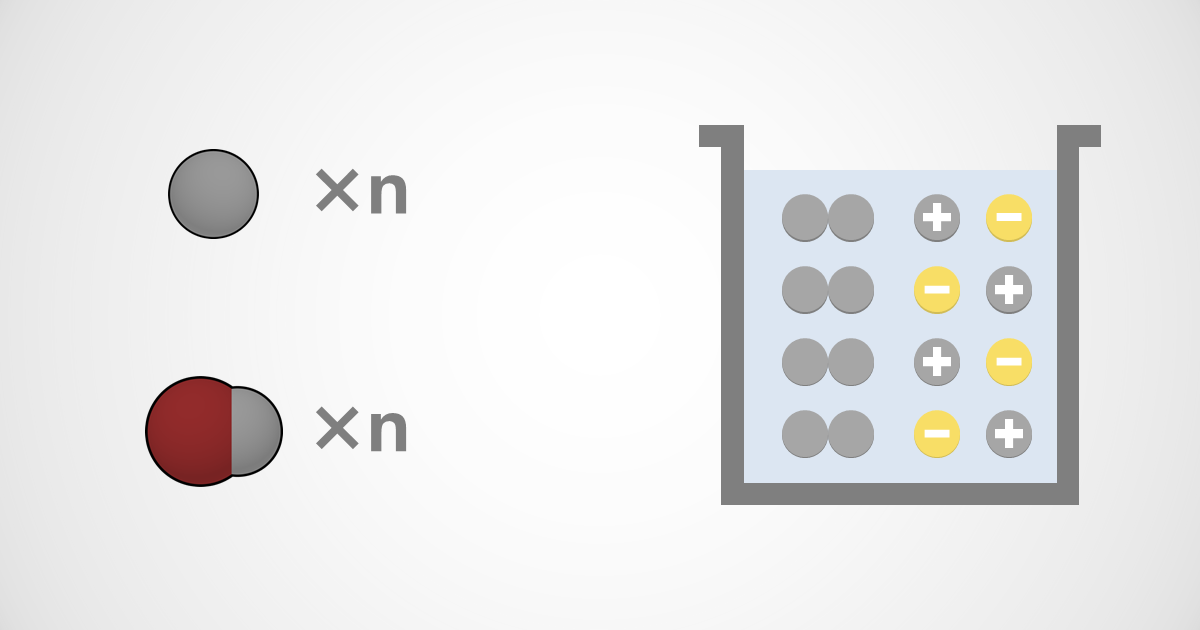
前ページでは、酸と塩基の定義について学んできましたが、今回は、分類について確認していきましょう。
価数(かすう)による分類と電離度(でんりど)による分類があります。
スポンサーリンク
酸・塩基の価数で分類
酸や塩基が電離して生じるH+やOH-の数で分類します。
酸の分類
電離したときに生じる水素イオンH+の数を酸の価数または塩基度(えんきど)といいます。
塩基度という用語は酸なのに、なぜ塩基?という疑問がわくかもしれません。塩基を中和できる度合いという意味で塩基度といいます。
以下にいくつかの例を示します。
1価の酸(1塩基酸)
価数が1の酸を1価の酸または1塩基酸(いちえんきさん)といいます。1塩基酸という用語は、1価の塩基を中和できる酸という意味です。
下の例では、化学式からHを1個持っていることから1価の酸であることがわかります。
- 塩酸 HCl
- 硝酸 HNO3
- 酢酸 CH3COOH
2価の酸(2塩基酸)
価数が2の酸を2価の酸または2塩基酸(にえんきさん)といいます。
- 硫酸 H2SO4
- 炭酸 H2CO3
- シュウ酸 (COOH)2
- 硫化水素 H2S
3価の酸(3塩基酸)
価数が3の酸を3価の酸または3塩基酸(さんえんきさん)といいます。
- リン酸 H3PO4
- ホウ酸 H3BO3
塩基の分類
電離したときに生じる水酸化物イオンOH-の数を塩基の価数または酸度(さんど)といいます。
酸度は、酸を中和できる度合いという意味で酸度といいます。
以下にいくつかの例を示します。
1価の塩基(1酸塩基)
価数が1の塩基を1価の塩基または1酸塩基(いちさんえんき)といいます。1酸塩基という用語は、1価の酸を中和できる塩基という意味です。
下の例では、アンモニアNH3以外は、化学式からOHを1個持っていることから1価の塩基であることがわかります。
- 水酸化ナトリウム NaOH
- 水酸化カリウム KOH
- アンモニア NH3 + H2O → NH4+ + OH-
アンモニアNH3は、水に溶けるとアンモニウムイオンNH4+を生成すると共に水酸化物イオンOH-1個が生じるため1価の塩基に分類されます。
2価の塩基(2酸塩基)
価数が2の塩基を2価の塩基または2酸塩基(にさんえんき)といいます。
- 水酸化カルシウム Ca(OH)2
- 水酸化バリウム Ba(OH)2
- 水酸化マグネシウム Mg(OH)2
- 水酸化銅 Cu(OH)2
3価の塩基(3酸塩基)
価数が3の塩基を3価の塩基または3酸塩基(さんさんえんき)といいます。
- 水酸化アルミニウム Al(OH)3
- 水酸化鉄(III) Fe(OH)3
スポンサーリンク
電離度の強弱で分類
酸や塩基の電離度(電離している割合)で分類します。
ちなみに、酸や塩基の強弱は、H+やOH-の数(価数)ではなく、どれだけ電離しているか(電離度)に依存します。
酸の分類
強酸と弱酸に分類できます。
強酸
電離度が1(100%)に近い酸を強酸(きょうさん)といいます。
- 塩酸 HCl
- 硫酸 H2SO4
- 硝酸 HNO3
- 過塩素酸 HClO4
弱酸
電離度が小さい酸を弱酸(じゃくさん)といいます。
- 酢酸 CH3COOH
- シュウ酸 (COOH)2
- 硫化水素 H2S
- ホウ酸 H3BO3
- フッ化水素酸 HF
- メタノール CH3OH
塩基の分類
強塩基と弱塩基に分類できます。
強塩基
電離度が1(100%)に近い塩基を強塩基(きょうえんき)といいます。
- 水酸化ナトリウム NaOH
- 水酸化カリウム KOH
- 水酸化カルシウム Ca(OH)2
- 水酸化バリウム Ba(OH)2
弱塩基
電離度が小さい塩基を弱塩基(じゃくえんき)といいます。
- アンモニア NH3
- 水酸化鉄(III) Fe(OH)3
- ピリジン C5H5N
スポンサーリンク