溶液と溶解度

ここでは、物質が液体に溶ける性質について学びます。
「溶解とは何か」、そして「溶解度は何に依存しているのか」について確認していきましょう。
スポンサーリンク
溶解
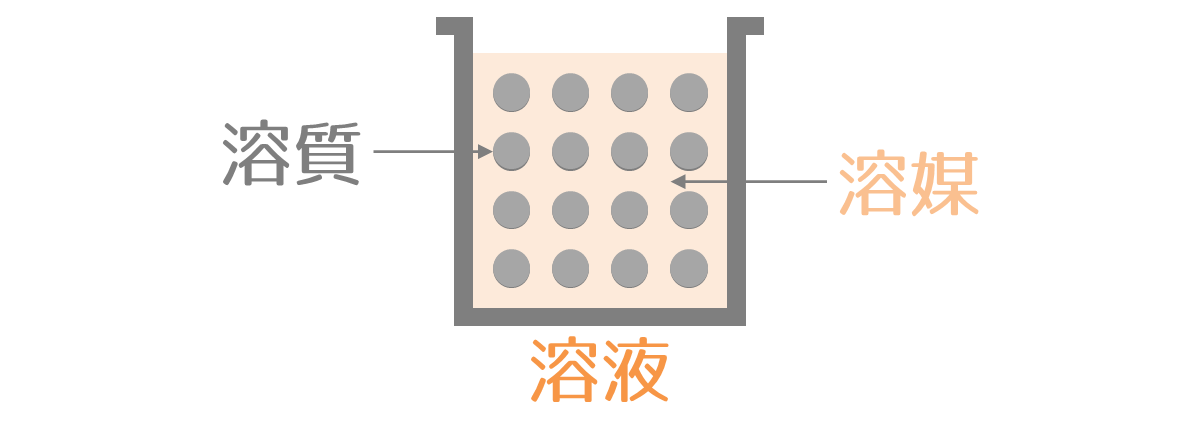
溶解(ようかい)とは、気体・液体・固体の物質が、他の液体に溶けて均一な混合物になることをいいます。
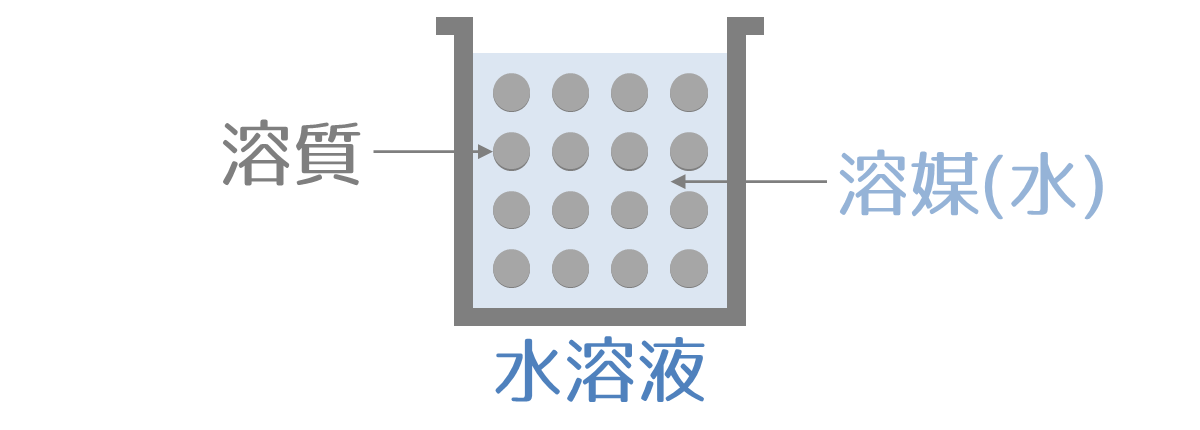
液体に溶けている物質を溶質(ようしつ)、溶質を溶かす液体を溶媒(ようばい)、溶質と溶媒の混合物を溶液(ようえき)といいます。
また、溶媒が水の溶液を水溶液(すいようえき)といいます。
溶解度とは
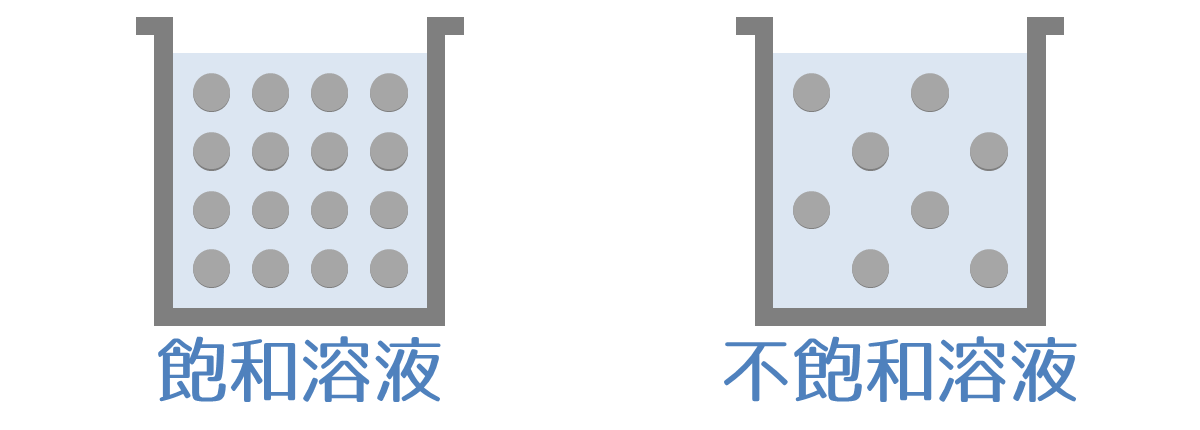
溶解度(ようかいど)とは、溶液に溶ける溶質の最大値をいいます。溶質が、溶液へどれくらいの量まで溶かすことができるかの限界値を表す数値です。
溶解度は、溶質が物質の三態のどの状態であるかによって異なります。
溶質が溶解度まで溶けている溶液を飽和溶液(ほうわようえき)、溶質が溶解度まで溶けていない溶液を不飽和溶液(ふほうわようえき)といいます。
固体の溶解度
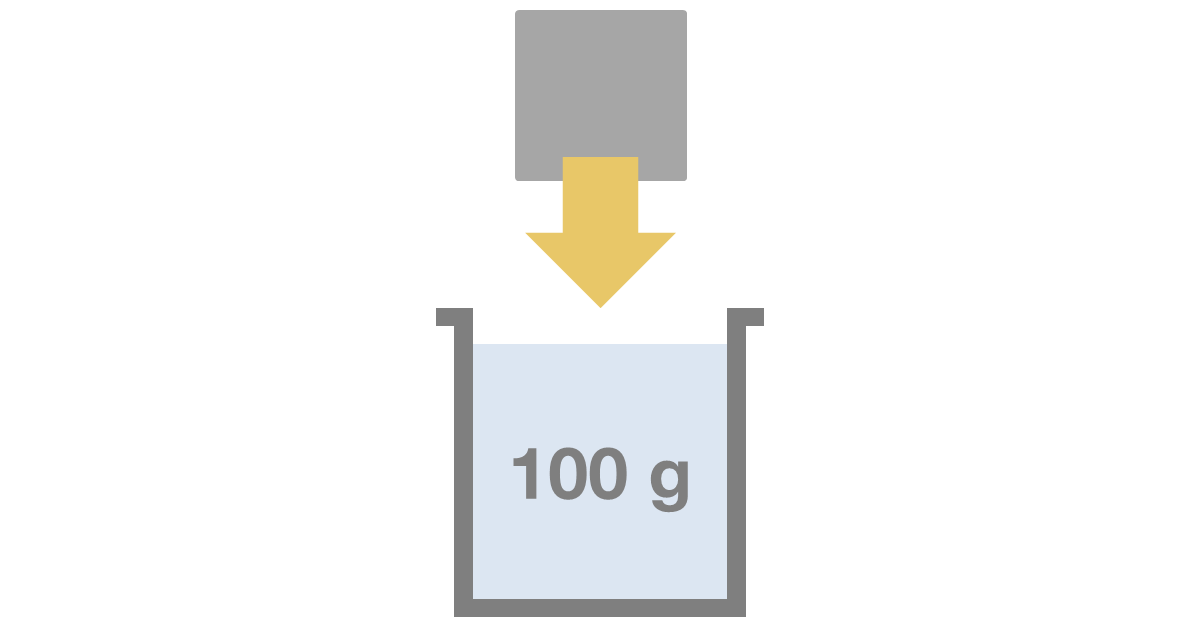
固体の溶解度は、ある温度で、溶媒100gに溶かすことのできる溶質の質量[g]で表します。
多くの物質は、温度が高くなるほど、溶解度は大きくなる傾向があります。
しかし、例外もあります。溶解度がほとんど変化しない例としては、塩化ナトリウム(NaOH)が、溶解度が小さくなる例としては水酸化カルシウム(Ca(OH)2)が知られています。
再結晶
固体の溶解度が物質や温度によって異なることを利用し、高温で飽和溶液をつくり、温度を下げることで溶けきれなくなった溶質を結晶として析出させ、不純物を取り除く方法のこと再結晶といいます。
気体の溶解度
気体の溶解度は、ある温度で溶媒1mLに溶かすことのできる溶質の体積[mL]を標準状態(0℃、1気圧)に換算した値で表します。
固体の溶解度とは逆に、温度が高くなるほど溶解度は小さくなる傾向があります。その理由は、温度が高くなると気体分子の熱運動が激しくなり、液体から飛び出す気体分子が増えるためです。
ヘンリーの法則
ヘンリーの法則とは、温度が一定のとき液体に溶ける気体の質量や物質量は圧力(分圧)に比例するという法則のことです。
ここで注意して頂きたいのは、溶ける気体の体積は、ボイルの法則が働くため一定になることです。
また、この法則は、次の場合に近似的に成り立ちます。
- 水に溶けにくい気体(溶解度の小さい気体)であること。
- 気体の圧力が小さいこと。
- 希薄溶液であること。
水に溶けやすい気体であるアンモニア(NH3)や塩化水素(HCl)では成り立ちません。
なお、ヘンリーの法則は、身近な例ではスキューバーダイビングにおける減圧症(潜水病)と深い関り合いがあります。
減圧症は、長時間の潜水を行うことで窒素が血液に溶けた状態で、水面に急浮上した場合に血液中で窒素の気化が起こり血流を止めるなどの障害を生じる現象です。
例えるならば、炭酸飲料のフタを開けた時に減圧して、溶けきれなくなった二酸化炭素が泡になって出てくる現象と似ています。
スポンサーリンク